李 牧 单安山 李仲玉
摘 要 抗菌肽是近年来发现的广泛存在于自然界中的一类阳离子抗菌活性肽,多数抗菌肽具有分子小、带正电、两亲性、抗菌谱广等共同特点。防御素和Cathelicidins是哺乳动物体内的两大主要抗菌肽家族,在哺乳动物的机体防御中起着重要的作用。猪源抗菌肽的一般性质、基因及其表达、在宿主防御中的作用、作用机理及研究前景将在文中予以概述。
关键词 猪;抗菌肽;防御素;Cathelicidins;作用机制
中图分类号 S816.79
近年来,由于药物的滥用,药物残留和细菌耐药性等问题日渐严重,不仅一直困扰着世界的养殖业,而且引发了人们对食品安全的关注,同时也给人类的健康带来潜在的威胁。越来越多的国家开始呼吁禁用抗生素,因此研制新一代的抗菌药物便成为一项新的课题。目前,一种新型的抗菌药物——抗菌肽作为传统抗生素的替代物以其自身的特征正受到人们的关注,具有广阔的应用前景。抗菌肽(Antibacterial peptides)是生物体产生的一种具有抗菌活性的多肽,1972年,瑞典科学家Boman等首先在果蝇中发现抗菌肽及其免疫功能,随后又从惜古比天蚕蛹中诱导分离得到,出并命名为Cecropin。迄今为止,已在许多生物中发现800多种这样的内源性抗菌肽,这些抗菌肽除了具有广谱的抗菌活性外,同时还有高效的抗真菌、抗病毒、抗原虫及抗肿瘤活性。因此,这些肽类抗菌物质显示了在医学和农业上潜在的研究和应用价值。
1 猪源抗菌肽的种类
目前已经从猪体内发现了12种以上不同的抗菌肽, 这些抗菌肽具有不同的螺旋结构, 分子量相对较小(小于10 kDa),但对多种微生物有广谱杀灭作用。根据抗菌肽前体的基因结构、氨基酸序列特征,可将猪源抗菌肽分为4 类:防御素(Defensins)超家族、Cathelicidins家族、Cecropins家族和NK-lysin。Cathelicidins和防御素是到目前为止在哺乳动物中所发现的两个最大群体的抗菌肽家族。
1.1 Cathelicidins家族
20世纪90年代,在进行bactenecin5 cDNA克隆时发现Cathelicidins与抗菌肽具有共同的结构特征,即N末端都含有一个Cathelin区域,所以在1995年将其命名为Cathelicidins。研究证明编码Cathelicidins基因有4个外显子和3个内含子(见图1)。前3个外显子编码前体区,第4个外显子编码酶切位点和抗菌区域。前体区含有123~144个氨基酸残基,包括一个29~30个残基的信号肽和一个长约94~144个氨基酸残基的Cathelin前段。C末端区域含有长12~97个氨基酸残基的成熟肽段。前体区具有高度的同源性,猪种内同源性达100%。Cathelin前段的C端区域有4个固定的半胱氨酸,形成2个二硫键。这些基因的5'端旁侧序列含有几个调控模体,包括参与炎症反应和急性期应答的核因子(nuclear factor,NF),如核因子白介素-6(NF-interleukin-6)、核因子КВ(NF-КВ)、白介素-6应答元素(interleukin-6 response element)、急性期应答因子(acute phase-response factor,APRF)和γ干扰素应答元素(γ-interferon response elements,γIRE)的位点。
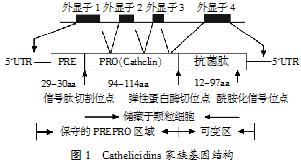
Cathelicidins以前肽原的形式存在,其N端为信号肽,C端是带阳离子的成熟肽段,另有带阴离子的Cathelin前段,可能用于中和阳离子肽段,使它在胞内运输、贮存时保持无活性的前肽状态,以避免细胞毒性。在多数情况下,这些抗菌肽的Cathelin区域被蛋白水解酶水解,释放出一级结构高度不同的阳离子抗菌肽。尽管Cathelicidins前肽原确切功能还不清楚,但研究者揣测这些分子有特异的生物学功能,而不仅仅是抗菌肽的贮存形式。
目前,已经至少从8种哺乳动物包括猪、水牛、兔等体内发现了30多种Cathelicidins。猪的Cathelicidins家族包括PR-39、Protegrins1~5、PMAP-23,36,37。它们都起源于骨髓细胞,组成性的以前肽(Propeptides)形式储存在周边PMNs(中性粒细胞)颗粒中。当PMNs激活和脱颗粒时,内源性弹性蛋白酶把成熟肽从前肽中切割出来。在一些情况下,这些肽通过C端酰胺化进一步修饰。
1.1.1 PR-39
PR-39(proline-arginine-rich 39-amino acid peptide)是含有39个氨基酸残基的小肽,分子量为4 719.7。经氨基酸序列分析,其一级结构中脯氨酸和精氨酸较多,其余为苯丙氨酸、亮氨酸、酪氨酸、异亮氨酸和甘氨酸。脯氨酸和精氨酸构成Pro-Arg-Pro结构,可能与细菌磷脂膜相互作用有关。PR-39主要活性是抗革兰氏阴性菌如大肠杆菌、鼠伤寒沙门氏菌、绿脓杆菌等。PR-39还有其它的重要功能,如通过结合p47phox的SH3结构域,强烈地抑制吞噬细胞NADPH氧化酶复合物的装配,引起活性氧类物质(ROS)的产生受到抑制,从而间接地减轻组织病理损伤。PR-39诱导癌细胞的共同结合蛋白聚糖-1表达,改变癌细胞侵袭表型和肌动蛋白结构。
1.1.2 Protegrins
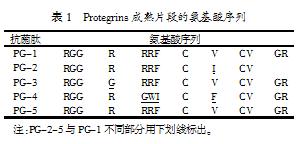
Protegrins基因结构同大多数Cathelicidins家族成员一样,包括4个外显子( E1~E4)和3个内含子。其中,E1的一部分编码Pre序列,即信号肽序列,功能是引导Propeptide进入细胞内; E1的另一部分和E2、E3及E4的一部分一起编码Pro序列,即所有Cathelicidins家族抗菌肽中同源性最高的部分(cathlinmotif),呈阴性的Pro片段,在功能上中和成熟的抗菌肽所带阳离子电荷,从而保持Propeptide在细胞内转运时无活性作用,并且避免细胞内毒性作用;Peptide 即发挥不同作用的成熟肽段。成熟的Protegrins含有16~18个氨基酸残基,因富含Cys和Arg而携带一定量的正电荷,因此是一种阳离子肽(见表1)。Protegrins都具有2个分子内二硫键,C端酰胺化,经二维核磁共振分析其二级结构呈β-折叠片。Protegrins的表达是在骨髓细胞分化的过程中进行的,因此在成熟的嗜中性粒细胞中很难找到它们的mRNA。Protegrins是受弹性蛋白酶调控的抗菌肽。Protegrin-1具有广谱的抗细菌和真菌的作用,可在体外杀死很多革兰氏阴性菌,如大肠杆菌、铜绿假单胞菌、鼠伤寒沙门氏菌和结核杆菌等。Hirokazu实验证明,Protegrin-1及人工合成的3种二硫键位置不同的异构体也都具有不同程度的抗人类HIV-1病毒的活性。大量实验还表明,性传播的沙眼衣原体、淋病奈瑟氏菌、单纯疱疹病毒-2和淋病双球菌等对Protegrins敏感度都很高。
1.1.3 其它Cathelicidins家族抗菌肽
PMAP-23,36,37(porcine myloid antimicrobial peptide,PMAP)属于猪髓源性抗菌肽,对其结构预测和圆二色谱分析表明PMAP-36,37具有两亲性α螺旋,而PMAP-23呈发卡样结构。体外试验表明合成的抗菌肽具有很强的抗菌活性。PMAP-37是最强的膜活性因子,在0.2~1 μmol/l时引起细菌细胞内膜的渗透作用,而PMAP-23,36的杀菌活性分别为1~10 μmol/l和10~50 μmol/l。PMAP-37在10~15 μmol/l时对人的红细胞有溶血作用,而PMAP-23,36在高于100 μmol/l时也未发现溶解红细胞的作用。
1.2 防御素家族
哺乳动物防御素是哺乳动物内在防御系统最大的成员,它是一类富含半胱氨酸的阳离子活性肽,可形成3对分子内二硫键,分子量为2~6 kDa。防御素广泛表达于哺乳动物的组织细胞中,在体外,微摩尔浓度的防御素具有广泛的抗菌活性,可以抵抗细菌、真菌,甚至一些被膜病毒。当微生物入侵时,抗菌肽前体通过蛋白酶水解处理,抗菌肽很快被释放出来。它们首先侵入病原微生物的带负电荷的磷脂膜来发挥抗菌功能。根据半胱氨酸的位置和二硫键的连接,哺乳动物的防御素进一步可分为3个群,即α、β、θ防御素。
1.2.1 β-防御素
β-防御素是一种富含半胱氨酸的阳离子多肽,含有6个稳定的半胱氨酸,分别以1-6、2-4、3-5连接形成三个分子的二硫键,构成稳定的反相平行的三股β-片层结构。二硫键可以使小分子防御素紧密联结以防御蛋白酶水解,所以在富含蛋白酶的吞噬溶酶体环境中仍能保持其特性,这也是防御素区别于其它抗微生物肽的主要因素。猪的上皮β-防御素pBD-1(porcine β-defensin 1)是目前在猪体内唯一被发现的防御素,pBD-1除上述结构外,还含有2个精氨酸、7个赖氨酸,且在成熟的肽中不含有阴离子残基。
根据氨基酸和核苷酸序列的保守性,可将pBD-1归类于诱导表达型。用猪舌的上皮细胞做培养试验,当用脂多糖(LPS)、肿瘤坏死因子-α(TNF-α)和白细胞介素-1(IL-1)刺激该细胞时,pBD-1 mRNA的含量无明显的变化;检测经沙门氏杆菌感染2 d的细胞,发现pBD-1 mRNA并未增加。这说明pBD-1并不受前炎因子LPS、TNF-α和白细胞介素-1的正向调控。重组的pBD-1具有很强的抗菌活性,可抵抗革兰氏阳性菌、阴性菌以及真菌。与其它防御素相似,pBD-1对微生物的杀灭是pH值、盐和血清依赖性的,当pH值小于5.5、高盐(100~150 mmol/l NaCl) 或有血清时都可以使之失活。
1.2.2 α-防御素
α-防御素最初是从豚鼠和兔子的多形核嗜中性粒细胞中分离出来的,α-防御素由29~35个氨基酸残基组成并具有6个保守的半胱氨酸形成的3对分子内二硫键,3对二硫键的连接位置分别为1-6、2-4、3-5 连接。目前已从猪体内的嗜中性粒细胞中分离出2种α-防御素(GPDEF1、2)。现在国内外对猪体内的α-防御素报道不多。
1.2.3 θ-防御素
Tang等通过反向高效液相色谱(RP-HPLC) 法从猕猴的白细胞中分离出一种呈环状结构的新型的防御素, 被称为猕猴θ型防御素1(RTD-1) , 每109个细胞中可分离出100 μg RTD-1。
1.3 其它抗菌肽家族
NK-lysin最初从猪小肠纯化得到,它含有78个氨基酸残基,由T淋巴细胞和NK细胞产生,是细胞毒性T细胞和NK细胞的一种新的效应分子。
Cecropin P1是第一个从猪小肠中分离的抗菌肽。Cecropin P1含有31个氨基酸残基,分子量是3 339,不含半胱氨酸(Cys),不能形成分子内二硫键,有强碱性的N端和强疏水性的C端,酰胺化的C端对其广谱抗菌作用极为重要。其氨基酸序列与昆虫CecropinIA有64%相似性,与CecropinB有75%的相似性。对其二级结构的理论预测及CD谱和二维核磁共振的数据分析表明,其分子内含有两亲性α-螺旋,中间是形成柔性弯曲的谷氨酸-甘氨酸(Glu-Gly)卷曲序列。Cecropin的抗革兰氏阴性菌的活性要高于抗革兰氏阳性菌的活性,但目前还不清楚由何种细胞产生。
2 抗菌肽的作用机制
抗菌肽首先与病原体细胞膜的靶部位产生相互作用。在这一过程中,起主要作用的是静电力和受体介导的细胞膜相互作用力。
2.1 静电力作用
抗菌肽的选择性与其电性有密切关系,不同种类的抗菌肽具有相当高的结构保守性,并且带有电荷。无论来源如何,抗菌肽都能形成两亲性结构,在生理pH值条件下,常带有正电荷。通常抗菌肽具有至少两个正电荷结构,带正电荷的抗菌肽与带负电荷的微生物细胞膜之间产生强烈的静电引力。Mavri等(1996)发现,许多含有赖氨酸残基和精氨酸残基的抗菌肽通过静电力与细胞膜磷脂双分子层的磷脂基团产生相互作用。
2.2 受体介导的细胞膜相互作用
抗菌肽与细胞膜结合后,细胞膜内肽与肽之间、肽与磷脂之间的相互作用形成一些复杂的空间结构,这些结构与抗菌肽的作用机理有一定的联系。肽与肽之间的、肽与细胞膜之间的疏水及亲水功能区相互作用,能使两亲性小肽比其它方式更深入细胞膜中心。通过这种方式构成的肽复合物可能形成跨膜通道或小孔,目前已经提出了多种抗菌肽跨膜机理模型,如栅桶模型、环孔模型、毯式模型、两态模型等。线性α-螺旋结构的抗菌肽(CecropinP1、PMAP-23,36,37)的抗菌活性是通过地毯式机制实现的,而有着β折叠结构的环肽如pBD-1、Protegrins、NK-lysin也许是通过桶-桶板机制起作用,与此机制相同的还有昆虫的Cecropins、嗜中性粒细胞分泌的α-防御素。另外,有研究表明,PR-39并不直接溶解细菌,而是诱导细菌DNA复制所必需的蛋白降解,从而最后杀死细菌。
抗菌肽同时发挥多种作用,达到迅速有效的抗菌活性,这些作用不可逆地破坏了细菌的细胞结构及功能。尽管不同类型的抗菌肽由于来源、组成及构象不同,具有很大的差异性,但也有一些共同的特征:通过静电力、疏水作用等亲合力与靶细胞相互作用,造成靶细胞膜构象变化。当抗菌肽浓度达到一定阈值时,在细胞膜上形成孔径或通道,使细胞膜破裂,细胞膜破裂后,直接或间接地丧失功能,抗菌肽穿过细胞膜进入细胞内的靶部位。
3 抗菌肽的应用前景
3.1 药用前景
随着传统抗生素的广泛及长期的应用,许多病源菌对它们产生了耐药性,而具有广谱抗菌且有独特抗菌机制的抗菌肽显然在这方面的应用研究中具有明显优势。随着对抗菌肽结构与活性的关系、抗菌肽作用机制及其基因表达调控机制认识的不断深化,开发一种高效的、有利于人类健康的抗菌肽作抗生素替代品是完全可行的。
癌症是人类疾病中的一大难题,目前使用的化疗药物能杀死癌细胞,但也同时杀死人体内正常细胞,副作用极大。抗菌肽能抑制某些肿瘤细胞的生长而对人体正常细胞无害,这给抗癌药物的开发带来了希望。美国费城马盖宁制药公司已于1990年开始对青蛙皮肤抗菌肽(magainin)进行结构与分子设计,筛选出一种对病毒和肿瘤细胞均有杀伤作用的小肽MA1278,目前已进入临床Ⅲ期实验。
3.2 转基因研究及应用
仔猪腹泻、奶牛乳房炎及各种病毒性疾病,如猪瘟、鸡新城疫等一直是棘手的疾病,不利于畜牧业的发展。借鉴已成功的昆虫抗菌肽转基因工程,如转基因蚊子、转基因马铃薯、转基因水稻等,把特异的抗菌肽基因转入畜禽特定细胞让其表达,从而产生抗病新品种,不失为一条发展畜牧生产的新思路,前景广阔。
3.3 抗菌肽基因表达调控及抗菌肽添加剂研究
研究表明,抗生素添加剂的使用严重破坏了动物肠道的微生物平衡,并易在动物体内残留,严重影响了畜产品的品质和人类的健康。用基因工程方法生产环保型抗菌肽添加剂,或者通过日粮因素调控抗菌肽基因的表达而达到畜产品无抗生素化,值得进一步研究。
然而,由于抗菌肽分子小,分离提纯存在一定的困难,故天然资源有限。化学合成和基因工程法获得抗菌肽是主要手段,但化学合成抗菌肽成本高,而通过基因工程在微生物中直接表达抗菌肽基因,则可能对宿主有害而不能获取表达产物。所以,对抗菌肽的结构、构效关系及作用机理还需进一步研究。
(参考文献35篇,刊略,需者可函索)
(编辑:张学智,mengzai007@163.com)
李牧,东北农业大学动物营养研究所,150030,哈尔滨。
单安山(通迅作者)、李仲玉,单位及通讯地址同第一作者。
收稿日期:2006-09-04
摘 要 抗菌肽是近年来发现的广泛存在于自然界中的一类阳离子抗菌活性肽,多数抗菌肽具有分子小、带正电、两亲性、抗菌谱广等共同特点。防御素和Cathelicidins是哺乳动物体内的两大主要抗菌肽家族,在哺乳动物的机体防御中起着重要的作用。猪源抗菌肽的一般性质、基因及其表达、在宿主防御中的作用、作用机理及研究前景将在文中予以概述。
关键词 猪;抗菌肽;防御素;Cathelicidins;作用机制
中图分类号 S816.79
近年来,由于药物的滥用,药物残留和细菌耐药性等问题日渐严重,不仅一直困扰着世界的养殖业,而且引发了人们对食品安全的关注,同时也给人类的健康带来潜在的威胁。越来越多的国家开始呼吁禁用抗生素,因此研制新一代的抗菌药物便成为一项新的课题。目前,一种新型的抗菌药物——抗菌肽作为传统抗生素的替代物以其自身的特征正受到人们的关注,具有广阔的应用前景。抗菌肽(Antibacterial peptides)是生物体产生的一种具有抗菌活性的多肽,1972年,瑞典科学家Boman等首先在果蝇中发现抗菌肽及其免疫功能,随后又从惜古比天蚕蛹中诱导分离得到,出并命名为Cecropin。迄今为止,已在许多生物中发现800多种这样的内源性抗菌肽,这些抗菌肽除了具有广谱的抗菌活性外,同时还有高效的抗真菌、抗病毒、抗原虫及抗肿瘤活性。因此,这些肽类抗菌物质显示了在医学和农业上潜在的研究和应用价值。
1 猪源抗菌肽的种类
目前已经从猪体内发现了12种以上不同的抗菌肽, 这些抗菌肽具有不同的螺旋结构, 分子量相对较小(小于10 kDa),但对多种微生物有广谱杀灭作用。根据抗菌肽前体的基因结构、氨基酸序列特征,可将猪源抗菌肽分为4 类:防御素(Defensins)超家族、Cathelicidins家族、Cecropins家族和NK-lysin。Cathelicidins和防御素是到目前为止在哺乳动物中所发现的两个最大群体的抗菌肽家族。
1.1 Cathelicidins家族
20世纪90年代,在进行bactenecin5 cDNA克隆时发现Cathelicidins与抗菌肽具有共同的结构特征,即N末端都含有一个Cathelin区域,所以在1995年将其命名为Cathelicidins。研究证明编码Cathelicidins基因有4个外显子和3个内含子(见图1)。前3个外显子编码前体区,第4个外显子编码酶切位点和抗菌区域。前体区含有123~144个氨基酸残基,包括一个29~30个残基的信号肽和一个长约94~144个氨基酸残基的Cathelin前段。C末端区域含有长12~97个氨基酸残基的成熟肽段。前体区具有高度的同源性,猪种内同源性达100%。Cathelin前段的C端区域有4个固定的半胱氨酸,形成2个二硫键。这些基因的5'端旁侧序列含有几个调控模体,包括参与炎症反应和急性期应答的核因子(nuclear factor,NF),如核因子白介素-6(NF-interleukin-6)、核因子КВ(NF-КВ)、白介素-6应答元素(interleukin-6 response element)、急性期应答因子(acute phase-response factor,APRF)和γ干扰素应答元素(γ-interferon response elements,γIRE)的位点。

Cathelicidins以前肽原的形式存在,其N端为信号肽,C端是带阳离子的成熟肽段,另有带阴离子的Cathelin前段,可能用于中和阳离子肽段,使它在胞内运输、贮存时保持无活性的前肽状态,以避免细胞毒性。在多数情况下,这些抗菌肽的Cathelin区域被蛋白水解酶水解,释放出一级结构高度不同的阳离子抗菌肽。尽管Cathelicidins前肽原确切功能还不清楚,但研究者揣测这些分子有特异的生物学功能,而不仅仅是抗菌肽的贮存形式。
目前,已经至少从8种哺乳动物包括猪、水牛、兔等体内发现了30多种Cathelicidins。猪的Cathelicidins家族包括PR-39、Protegrins1~5、PMAP-23,36,37。它们都起源于骨髓细胞,组成性的以前肽(Propeptides)形式储存在周边PMNs(中性粒细胞)颗粒中。当PMNs激活和脱颗粒时,内源性弹性蛋白酶把成熟肽从前肽中切割出来。在一些情况下,这些肽通过C端酰胺化进一步修饰。
1.1.1 PR-39
PR-39(proline-arginine-rich 39-amino acid peptide)是含有39个氨基酸残基的小肽,分子量为4 719.7。经氨基酸序列分析,其一级结构中脯氨酸和精氨酸较多,其余为苯丙氨酸、亮氨酸、酪氨酸、异亮氨酸和甘氨酸。脯氨酸和精氨酸构成Pro-Arg-Pro结构,可能与细菌磷脂膜相互作用有关。PR-39主要活性是抗革兰氏阴性菌如大肠杆菌、鼠伤寒沙门氏菌、绿脓杆菌等。PR-39还有其它的重要功能,如通过结合p47phox的SH3结构域,强烈地抑制吞噬细胞NADPH氧化酶复合物的装配,引起活性氧类物质(ROS)的产生受到抑制,从而间接地减轻组织病理损伤。PR-39诱导癌细胞的共同结合蛋白聚糖-1表达,改变癌细胞侵袭表型和肌动蛋白结构。
1.1.2 Protegrins
Protegrins基因结构同大多数Cathelicidins家族成员一样,包括4个外显子( E1~E4)和3个内含子。其中,E1的一部分编码Pre序列,即信号肽序列,功能是引导Propeptide进入细胞内; E1的另一部分和E2、E3及E4的一部分一起编码Pro序列,即所有Cathelicidins家族抗菌肽中同源性最高的部分(cathlinmotif),呈阴性的Pro片段,在功能上中和成熟的抗菌肽所带阳离子电荷,从而保持Propeptide在细胞内转运时无活性作用,并且避免细胞内毒性作用;Peptide 即发挥不同作用的成熟肽段。成熟的Protegrins含有16~18个氨基酸残基,因富含Cys和Arg而携带一定量的正电荷,因此是一种阳离子肽(见表1)。Protegrins都具有2个分子内二硫键,C端酰胺化,经二维核磁共振分析其二级结构呈β-折叠片。Protegrins的表达是在骨髓细胞分化的过程中进行的,因此在成熟的嗜中性粒细胞中很难找到它们的mRNA。Protegrins是受弹性蛋白酶调控的抗菌肽。Protegrin-1具有广谱的抗细菌和真菌的作用,可在体外杀死很多革兰氏阴性菌,如大肠杆菌、铜绿假单胞菌、鼠伤寒沙门氏菌和结核杆菌等。Hirokazu实验证明,Protegrin-1及人工合成的3种二硫键位置不同的异构体也都具有不同程度的抗人类HIV-1病毒的活性。大量实验还表明,性传播的沙眼衣原体、淋病奈瑟氏菌、单纯疱疹病毒-2和淋病双球菌等对Protegrins敏感度都很高。

1.1.3 其它Cathelicidins家族抗菌肽
PMAP-23,36,37(porcine myloid antimicrobial peptide,PMAP)属于猪髓源性抗菌肽,对其结构预测和圆二色谱分析表明PMAP-36,37具有两亲性α螺旋,而PMAP-23呈发卡样结构。体外试验表明合成的抗菌肽具有很强的抗菌活性。PMAP-37是最强的膜活性因子,在0.2~1 μmol/l时引起细菌细胞内膜的渗透作用,而PMAP-23,36的杀菌活性分别为1~10 μmol/l和10~50 μmol/l。PMAP-37在10~15 μmol/l时对人的红细胞有溶血作用,而PMAP-23,36在高于100 μmol/l时也未发现溶解红细胞的作用。
1.2 防御素家族
哺乳动物防御素是哺乳动物内在防御系统最大的成员,它是一类富含半胱氨酸的阳离子活性肽,可形成3对分子内二硫键,分子量为2~6 kDa。防御素广泛表达于哺乳动物的组织细胞中,在体外,微摩尔浓度的防御素具有广泛的抗菌活性,可以抵抗细菌、真菌,甚至一些被膜病毒。当微生物入侵时,抗菌肽前体通过蛋白酶水解处理,抗菌肽很快被释放出来。它们首先侵入病原微生物的带负电荷的磷脂膜来发挥抗菌功能。根据半胱氨酸的位置和二硫键的连接,哺乳动物的防御素进一步可分为3个群,即α、β、θ防御素。
1.2.1 β-防御素
β-防御素是一种富含半胱氨酸的阳离子多肽,含有6个稳定的半胱氨酸,分别以1-6、2-4、3-5连接形成三个分子的二硫键,构成稳定的反相平行的三股β-片层结构。二硫键可以使小分子防御素紧密联结以防御蛋白酶水解,所以在富含蛋白酶的吞噬溶酶体环境中仍能保持其特性,这也是防御素区别于其它抗微生物肽的主要因素。猪的上皮β-防御素pBD-1(porcine β-defensin 1)是目前在猪体内唯一被发现的防御素,pBD-1除上述结构外,还含有2个精氨酸、7个赖氨酸,且在成熟的肽中不含有阴离子残基。
根据氨基酸和核苷酸序列的保守性,可将pBD-1归类于诱导表达型。用猪舌的上皮细胞做培养试验,当用脂多糖(LPS)、肿瘤坏死因子-α(TNF-α)和白细胞介素-1(IL-1)刺激该细胞时,pBD-1 mRNA的含量无明显的变化;检测经沙门氏杆菌感染2 d的细胞,发现pBD-1 mRNA并未增加。这说明pBD-1并不受前炎因子LPS、TNF-α和白细胞介素-1的正向调控。重组的pBD-1具有很强的抗菌活性,可抵抗革兰氏阳性菌、阴性菌以及真菌。与其它防御素相似,pBD-1对微生物的杀灭是pH值、盐和血清依赖性的,当pH值小于5.5、高盐(100~150 mmol/l NaCl) 或有血清时都可以使之失活。
1.2.2 α-防御素
α-防御素最初是从豚鼠和兔子的多形核嗜中性粒细胞中分离出来的,α-防御素由29~35个氨基酸残基组成并具有6个保守的半胱氨酸形成的3对分子内二硫键,3对二硫键的连接位置分别为1-6、2-4、3-5 连接。目前已从猪体内的嗜中性粒细胞中分离出2种α-防御素(GPDEF1、2)。现在国内外对猪体内的α-防御素报道不多。
1.2.3 θ-防御素
Tang等通过反向高效液相色谱(RP-HPLC) 法从猕猴的白细胞中分离出一种呈环状结构的新型的防御素, 被称为猕猴θ型防御素1(RTD-1) , 每109个细胞中可分离出100 μg RTD-1。
1.3 其它抗菌肽家族
NK-lysin最初从猪小肠纯化得到,它含有78个氨基酸残基,由T淋巴细胞和NK细胞产生,是细胞毒性T细胞和NK细胞的一种新的效应分子。
Cecropin P1是第一个从猪小肠中分离的抗菌肽。Cecropin P1含有31个氨基酸残基,分子量是3 339,不含半胱氨酸(Cys),不能形成分子内二硫键,有强碱性的N端和强疏水性的C端,酰胺化的C端对其广谱抗菌作用极为重要。其氨基酸序列与昆虫CecropinIA有64%相似性,与CecropinB有75%的相似性。对其二级结构的理论预测及CD谱和二维核磁共振的数据分析表明,其分子内含有两亲性α-螺旋,中间是形成柔性弯曲的谷氨酸-甘氨酸(Glu-Gly)卷曲序列。Cecropin的抗革兰氏阴性菌的活性要高于抗革兰氏阳性菌的活性,但目前还不清楚由何种细胞产生。
2 抗菌肽的作用机制
抗菌肽首先与病原体细胞膜的靶部位产生相互作用。在这一过程中,起主要作用的是静电力和受体介导的细胞膜相互作用力。
2.1 静电力作用
抗菌肽的选择性与其电性有密切关系,不同种类的抗菌肽具有相当高的结构保守性,并且带有电荷。无论来源如何,抗菌肽都能形成两亲性结构,在生理pH值条件下,常带有正电荷。通常抗菌肽具有至少两个正电荷结构,带正电荷的抗菌肽与带负电荷的微生物细胞膜之间产生强烈的静电引力。Mavri等(1996)发现,许多含有赖氨酸残基和精氨酸残基的抗菌肽通过静电力与细胞膜磷脂双分子层的磷脂基团产生相互作用。
2.2 受体介导的细胞膜相互作用
抗菌肽与细胞膜结合后,细胞膜内肽与肽之间、肽与磷脂之间的相互作用形成一些复杂的空间结构,这些结构与抗菌肽的作用机理有一定的联系。肽与肽之间的、肽与细胞膜之间的疏水及亲水功能区相互作用,能使两亲性小肽比其它方式更深入细胞膜中心。通过这种方式构成的肽复合物可能形成跨膜通道或小孔,目前已经提出了多种抗菌肽跨膜机理模型,如栅桶模型、环孔模型、毯式模型、两态模型等。线性α-螺旋结构的抗菌肽(CecropinP1、PMAP-23,36,37)的抗菌活性是通过地毯式机制实现的,而有着β折叠结构的环肽如pBD-1、Protegrins、NK-lysin也许是通过桶-桶板机制起作用,与此机制相同的还有昆虫的Cecropins、嗜中性粒细胞分泌的α-防御素。另外,有研究表明,PR-39并不直接溶解细菌,而是诱导细菌DNA复制所必需的蛋白降解,从而最后杀死细菌。
抗菌肽同时发挥多种作用,达到迅速有效的抗菌活性,这些作用不可逆地破坏了细菌的细胞结构及功能。尽管不同类型的抗菌肽由于来源、组成及构象不同,具有很大的差异性,但也有一些共同的特征:通过静电力、疏水作用等亲合力与靶细胞相互作用,造成靶细胞膜构象变化。当抗菌肽浓度达到一定阈值时,在细胞膜上形成孔径或通道,使细胞膜破裂,细胞膜破裂后,直接或间接地丧失功能,抗菌肽穿过细胞膜进入细胞内的靶部位。
3 抗菌肽的应用前景
3.1 药用前景
随着传统抗生素的广泛及长期的应用,许多病源菌对它们产生了耐药性,而具有广谱抗菌且有独特抗菌机制的抗菌肽显然在这方面的应用研究中具有明显优势。随着对抗菌肽结构与活性的关系、抗菌肽作用机制及其基因表达调控机制认识的不断深化,开发一种高效的、有利于人类健康的抗菌肽作抗生素替代品是完全可行的。
癌症是人类疾病中的一大难题,目前使用的化疗药物能杀死癌细胞,但也同时杀死人体内正常细胞,副作用极大。抗菌肽能抑制某些肿瘤细胞的生长而对人体正常细胞无害,这给抗癌药物的开发带来了希望。美国费城马盖宁制药公司已于1990年开始对青蛙皮肤抗菌肽(magainin)进行结构与分子设计,筛选出一种对病毒和肿瘤细胞均有杀伤作用的小肽MA1278,目前已进入临床Ⅲ期实验。
3.2 转基因研究及应用
仔猪腹泻、奶牛乳房炎及各种病毒性疾病,如猪瘟、鸡新城疫等一直是棘手的疾病,不利于畜牧业的发展。借鉴已成功的昆虫抗菌肽转基因工程,如转基因蚊子、转基因马铃薯、转基因水稻等,把特异的抗菌肽基因转入畜禽特定细胞让其表达,从而产生抗病新品种,不失为一条发展畜牧生产的新思路,前景广阔。
3.3 抗菌肽基因表达调控及抗菌肽添加剂研究
研究表明,抗生素添加剂的使用严重破坏了动物肠道的微生物平衡,并易在动物体内残留,严重影响了畜产品的品质和人类的健康。用基因工程方法生产环保型抗菌肽添加剂,或者通过日粮因素调控抗菌肽基因的表达而达到畜产品无抗生素化,值得进一步研究。
然而,由于抗菌肽分子小,分离提纯存在一定的困难,故天然资源有限。化学合成和基因工程法获得抗菌肽是主要手段,但化学合成抗菌肽成本高,而通过基因工程在微生物中直接表达抗菌肽基因,则可能对宿主有害而不能获取表达产物。所以,对抗菌肽的结构、构效关系及作用机理还需进一步研究。
(参考文献35篇,刊略,需者可函索)
(编辑:张学智,mengzai007@163.com)
李牧,东北农业大学动物营养研究所,150030,哈尔滨。
单安山(通迅作者)、李仲玉,单位及通讯地址同第一作者。
收稿日期:2006-09-04





