马小珍(译) 薛晓生 王碧莲 周 围 姚雄军(校)
摘 要 小肽和游离氨基酸是日粮蛋白在小肠中主要的消化产物,目前尚不明确这两种物质间的转运干扰。本试验用Caco-2细胞来研究PEPT1转运的二肽吸收是否会改变游离酸性、中性氨基酸的吸收。L-[3H]Arg转运到Caco-2细胞是非依赖Na+,而主要是受b0,+转运系统的调节。10 mmol/l二肽培养的细胞能将L-Arg流速提高到4倍。本试验首次证明,小肠细胞内游离氨基酸和小肽的吸收相互影响,并能改变氨基酸吸收的动力学。
关键词 二肽PEPT1;bo,+系统;肠道氨基酸
中图分类号 Q517
日粮蛋白和内源性蛋白经胰蛋白酶、小肠刷状缘蛋白酶和肽酶消化后形成小肽和游离氨基酸。小肠细胞顶端细胞膜内几种直接的转运系统调节游离氨基酸的吸收,但二肽与三肽的吸收是基于PEPT1系统完成。虽然肽与氨基酸的转运均会导致氨态氮吸收入小肠,但不同转运系统对氨基酸吸收的影响仍不明确。虽然氨基酸不会影响PEPT1系统转运肽,但尚不明确细胞水解后肽的吸收是否会影响游离氨基酸进入上皮细胞。Caco-2细胞来源于人体肠道上皮细胞,是一个有价值的体外研究模型,可以模拟酸性、碱性、中性氨基酸转运系统及PEPT1转运系统。
本次研究中,为了能模拟不同的转运系统,试验采用的是融合后14 d的Caco-2细胞。首先,试验明确了不同转运系统对放射性标记的酸性左旋精氨酸(L-Arg)、中性左旋丙氨酸(L-Ala)吸收的影响。本次试验主要目的是研究细胞经用含有精氨酸、丙氨酸的二肽处理后,对L-Arg与 L-Ala转运率的影响。为了便于研究二肽对氨基酸流速的影响,试验应用胶原蛋白培养的Caco-2细胞,降低非特异性转运系统对氨基酸、肽转运的影响。
1 材料和方法
1.1 材料
合成D-[3H]Phe-L-Ala(9 Ci/mmol)和未标记的D-Phe-L-Ala分别购自Biotrend和Bachem公司,L-[3H]Arg(50 Ci/mmol)由Amersham公司提供,L-[3H]Ala (96 Ci/mmol)由ICN提供,其它的氨基酸和肽均购自Sigma公司。细胞培养皿和培养瓶购自Renner公司,细胞培养所需的其它材料来自Gibco公司,胶原蛋白购自Serva公司。
1.2 细胞培养
Caco-2细胞(ATCC)培养、传代均用DMEM培养液 (含10%胎牛血清、2 mmol/l谷氨酰胺、1% MEM非必需氨基酸、70 μg/ml庆大霉素),在37 ℃、5% CO2条件下进行。
1.3 转运研究
Caco-2细胞的流动研究是在Krebs缓冲器中进行,其内配有137 mmol/l NaCl、5.4 mmol/l KCl、2.8 mmol/l CaCl2、1.0 mmol/l MgSO4、0.3 mmol/l NaH2PO4、0.3 mmol/l KH2PO4、10 mmol/l葡萄糖和10 mmol/l HEPES/Tris(pH值7.4)。在无Na+缓冲器中,137 mmol/l氯化胆碱替代137 mmol/l NaCl,0.3 mmol/l KH2PO4替代0.3 mmol/l NaH2PO4,其它成分相同。研究吸收率时,洗脱培养在24孔板中的单层细胞以去除培养液,然后在37 ℃下与竞争底物和放射性标记底物或仅与放射性标记底物一起培养30 min,然后用冰点的培养缓冲液洗脱3次,每孔加50 μl TEN缓冲液,并加50 μl组织增溶剂进行消化。通过检测细胞放射性来确定示踪元素的导入。细胞培养条件:培养时间为30 min,培养温度37 ℃,二肽及二肽组成氨基酸的浓度均为10 mmol/l。
1.4 统计
所有分析(线性或非线性回归分析)均用Prism2.01完成,数据以平均值±标准误(SEM)表示,差异显著性用Student t检验。
2 结果与分析
2.1 Caco-2细胞中L-[3H]Arg和L-[3H]Ala的转运特点(见图1、图2)
A
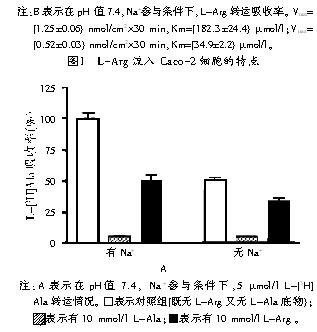

氨基酸转运试验是在pH值7.4条件下进行的,以降低H+依赖转运体系对氨基酸吸收的影响。无论是否有Na+的参与,在10 mmol/l L-Arg试验组中,5 μmol/l 有放射性标记的酸性 L-[3H]Arg吸收率都下降到对照组的7% (见图1A)。在Na+参与下,10 mmol/l L-Ala试验组与对照组相比,5 μmol/l 有放射标记的酸性 L-[3H]Arg吸收率下降了83%(见图1A);在既无L-Arg又无L-Ala底物的对照组中,在无Na+参与时5 μmol/l L-[3H]Arg的吸收率是有Na+的条件下的2倍(见图1A)。无Na+参与下,酸性氨基酸(如L-Lys)吸收率更高,这是由于电敏感机制引起的,该机制会受到Na+的抑制。L-Ala(10 mmol/l)降低了非依赖Na+ L-[3H]Arg 吸收率的85%,这表明氨基酸的移动是由b0,+系统转运的,该系统可在无Na+的条件下转运酸性、中性氨基酸。15%的L-[3H]Arg吸收是不受L-Ala的影响,而是由Y+系统(不依赖Na+可转运酸性氨基酸)转运或者是由Y+L系统(在无Na+的条件下转运酸性氨基酸,在有Na+的条件下转运中性氨基酸)转运。
为评定L-Arg的吸收是否被这两种转运通道所调节,我们作出了一个流速与底物浓度间的函数图。转运率表示饱和动力学(见图1B),速率的变化表示相关性的高低,这两种转运通道的Km值分别是(182.3±24.4) μmol/l、(34.9±2.2) μmol/l(见图1B)。
L-[3H]Ala转运到Caco-2细胞主要受转运系统的调节而不受L-[3H]Arg吸收的影响。无Na+参与下,L-[3H]Ala的转运仅是有Na+条件下的一半(见图2A)。无Na+条件下,10 mmol/l L-Arg抑制了30%的L-[3H]Ala吸收(见图2A)。在有Na+条件下,L-[3H]Ala的吸收是无Na+条件下的2倍,这是由于Na+存在时,b0,+系统转运了15% L-Ala。研究表明,几种转运系统均参与了L-Ala的吸收转运,L-[3H]Ala速率动力学显示Km值基本是一常数,约为150 μmol/l(见图2B),这也说明参与 L-Ala吸收转运的不同转运系统的Km值基本相同。
2.2 二肽和游离氨基酸处理过的Caco-2细胞对L-[3H]Ala、L-[3H]Arg流速的影响
二肽浓度不断升高的情况下,测量5 μmol/l D-[3H]Phe-L-Ala吸收率,从而研究二肽与PEPT1的相关性(见图3)。EC50值分别是:L-Lys-L-Lys为(411.1±15.3) μmol/l,Gly-L-Arg为(412.7±13.7) μmol/l,Gly-L-His为(42.0±6.5) μmol/l,L-Ala-L-Ala为(271.3±12.4) μmol/l(见图3)。上述任一种二肽浓度为10 mmol/l时,转运系统的转运速度均达最大值Vmax。在前处理过程中,分别用10 mmol/l L-Lys-L-Lys、Gly-L-Arg、Gly-L-His 、L-Ala-L-Ala 培养Caco-2细胞;同时用同摩尔浓度的氨基酸(二肽的组成氨基酸)进行预培养,并比较二肽与游离氨基酸转运系统间的影响作用。阴性对照(底物为10 mmol/l Gly-Gly或20 mmol/l Gly)说明b0,+系统对L-[3H]Arg吸收的影响,然后计算L-[3H]Arg(50 Ci/mmol)和L-[3H]Ala进入Caco-2细胞的速度。

除了Gly(无论是以二肽形式还是以游离形式)外,其它任一种前培养方式均明显提高了Caco-2细胞对L-[3H]Arg的吸收速度(见表1)。用二肽培养后的吸收速度较氨基酸的快,二肽与氨基酸混合物培养后吸收速度最快。用Gly-L-Arg、Gly、L-Arg混合物或L-Ala-L-Ala、L-Ala混合物前培养Caco-2细胞后,L-[3H]Arg的吸收速度提高了4.6倍(见表1)。与L-[3H]Arg转运相反,用L-Ala-L-Ala、Gly-L-Arg、L-Lys-L-Lys 或其组成氨基酸或二肽与氨基酸的混合物培养Caco-2细胞后,L-[3H]Ala的吸收速度均没有显著提高(见表2)。


2.3 二肽胞内水解促进L-[3H]Arg吸收
以下试验证明了二肽胞内水解是L-[3H]Ala的吸收前提条件:①非水解的D-Phe-L-Ala 不能促进L-[3H]Ala的转运(见表3);②先用氨肽酶抑制剂(Amastatin)前处理细胞以抑制胞内水解,然后再与Gly-L-Arg进行前培养抑制胞外水解后,不能促进转运(见表3)。Amastatin广泛用作肽水解抑制剂,且其不会干扰上皮细胞肽转运系统,因此Amastatin是通过抑制Gly-L-Arg的水解阻碍Gly-L-Arg的吸收。细胞经游离氨基酸前处理后,Amastatin不能影响细胞跨膜转运,这也说明了Amastatin对水解的特殊作用(见表3)。

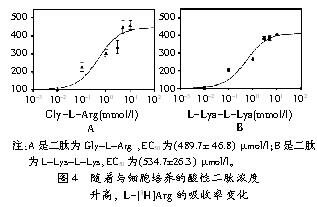
L-[3H]Arg吸收的限速步骤是二肽转运到细胞还是二肽胞内水解呢?试验证明,限速步骤是转运而不是水解(见图4)。通过Gly-L-Arg或L-Lys-L-Lys前处理细胞试验发现L-Arg流速达1/2 Vmax时Gly-L-Arg是(489.7±46.8) μmol/l,L-Lys-L-Lys是(534.7±26.3) μmol/l (见图4)。L-[3H]Arg 跨膜转运EC50值的大小相似于同PEPT1作用的肽的引力(见图3)。
3 讨论
小肠中氨态氮吸收既以游离形式,又以二肽、三肽的形式,但不同的转运系统对氨基酸吸收影响程度尚不明确。以往试验没有在细胞水平研究氨基酸和二肽吸收的相互作用,因这种研究适宜于在类似提取细胞的组织环境下进行。本试验选用的是Caco-2细胞。
通过Caco-2细胞研究试验,证明了二肽转运和酸性氨基酸转运间的相互作用。酸性L-Lys受到两种转运系统的调节,一个是非依赖Na+酸性、中性氨基酸转运系统,另一个是特定氨基酸转运系统。在以前研究中,第一个系统即b0,+系统能转运47%L-Lys,特定酸性氨基酸转运系统Y+转运27%,浓度差转运26%。64%是由载体转运系统b0,+转运,36%由系统Y+转运。在本次研究中,L-[3H]Arg 85%由系统b0,+调节,15%由系统Y+调节。经系统b0,+转运L-Arg的比率更高,原因是细胞不同、生长因子不同。
酸性、中性氨基酸吸收必须要有系统b0,+转运,对L-Ala吸收比依赖Na+转运低15%。在Na+存在下,转运中性、酸性氨基酸的b0,+系统只转运L-Ala 吸收总量的35%。b0,+转运系统仍未在肠道组织分子水平上得以证实。原名为NBB转运系统更名为系统b,能更好地反映出与系统b0,+的关系。
显然,与L-Arg及其转运系统相反,L-Ala的流速不受前培养物(无论是酸性、中性氨基酸还是二肽)的影响。15%L-Ala吸收量是系统b0,+转运,内源氨基酸不能显著影响L-Ala流速。
本次试验第一次在细胞水平证实小肽与游离氨基酸吸收之间相互作用,并为PEPT1对氨基酸吸收的调节作用提供了证据。小肽转运系统可转运400多种二肽和8 000种三肽,能显著改善肠道游离氨基酸的转运。PEPT1可转运大量小肽到肠道上皮细胞,这些小肽水解后释放出游离氨基酸,从而促进必需氨基酸如L-Arg、L-Lys的吸收。小肽转运系统能促进肠道氨基酸的吸收。首先,二肽、三肽(含有必需氨基酸)的转运避免了必需氨基酸参与氨基酸转运系统的竞争;其次,由于增加细胞内游离氨基酸含量,从而能促进必需氨基酸的吸收。
(编辑:刘敏跃,lm-y@tom.com)
马小珍,福建出入境检验检疫局,850001,福州市湖东路312号。
薛晓生、王碧莲、周围、姚雄军,华达生化科技饲料(湖北)有限公司。
收稿日期:2007-01-23
注:译自细胞生理学杂志,2001(186):251~259
摘 要 小肽和游离氨基酸是日粮蛋白在小肠中主要的消化产物,目前尚不明确这两种物质间的转运干扰。本试验用Caco-2细胞来研究PEPT1转运的二肽吸收是否会改变游离酸性、中性氨基酸的吸收。L-[3H]Arg转运到Caco-2细胞是非依赖Na+,而主要是受b0,+转运系统的调节。10 mmol/l二肽培养的细胞能将L-Arg流速提高到4倍。本试验首次证明,小肠细胞内游离氨基酸和小肽的吸收相互影响,并能改变氨基酸吸收的动力学。
关键词 二肽PEPT1;bo,+系统;肠道氨基酸
中图分类号 Q517
日粮蛋白和内源性蛋白经胰蛋白酶、小肠刷状缘蛋白酶和肽酶消化后形成小肽和游离氨基酸。小肠细胞顶端细胞膜内几种直接的转运系统调节游离氨基酸的吸收,但二肽与三肽的吸收是基于PEPT1系统完成。虽然肽与氨基酸的转运均会导致氨态氮吸收入小肠,但不同转运系统对氨基酸吸收的影响仍不明确。虽然氨基酸不会影响PEPT1系统转运肽,但尚不明确细胞水解后肽的吸收是否会影响游离氨基酸进入上皮细胞。Caco-2细胞来源于人体肠道上皮细胞,是一个有价值的体外研究模型,可以模拟酸性、碱性、中性氨基酸转运系统及PEPT1转运系统。
本次研究中,为了能模拟不同的转运系统,试验采用的是融合后14 d的Caco-2细胞。首先,试验明确了不同转运系统对放射性标记的酸性左旋精氨酸(L-Arg)、中性左旋丙氨酸(L-Ala)吸收的影响。本次试验主要目的是研究细胞经用含有精氨酸、丙氨酸的二肽处理后,对L-Arg与 L-Ala转运率的影响。为了便于研究二肽对氨基酸流速的影响,试验应用胶原蛋白培养的Caco-2细胞,降低非特异性转运系统对氨基酸、肽转运的影响。
1 材料和方法
1.1 材料
合成D-[3H]Phe-L-Ala(9 Ci/mmol)和未标记的D-Phe-L-Ala分别购自Biotrend和Bachem公司,L-[3H]Arg(50 Ci/mmol)由Amersham公司提供,L-[3H]Ala (96 Ci/mmol)由ICN提供,其它的氨基酸和肽均购自Sigma公司。细胞培养皿和培养瓶购自Renner公司,细胞培养所需的其它材料来自Gibco公司,胶原蛋白购自Serva公司。
1.2 细胞培养
Caco-2细胞(ATCC)培养、传代均用DMEM培养液 (含10%胎牛血清、2 mmol/l谷氨酰胺、1% MEM非必需氨基酸、70 μg/ml庆大霉素),在37 ℃、5% CO2条件下进行。
1.3 转运研究
Caco-2细胞的流动研究是在Krebs缓冲器中进行,其内配有137 mmol/l NaCl、5.4 mmol/l KCl、2.8 mmol/l CaCl2、1.0 mmol/l MgSO4、0.3 mmol/l NaH2PO4、0.3 mmol/l KH2PO4、10 mmol/l葡萄糖和10 mmol/l HEPES/Tris(pH值7.4)。在无Na+缓冲器中,137 mmol/l氯化胆碱替代137 mmol/l NaCl,0.3 mmol/l KH2PO4替代0.3 mmol/l NaH2PO4,其它成分相同。研究吸收率时,洗脱培养在24孔板中的单层细胞以去除培养液,然后在37 ℃下与竞争底物和放射性标记底物或仅与放射性标记底物一起培养30 min,然后用冰点的培养缓冲液洗脱3次,每孔加50 μl TEN缓冲液,并加50 μl组织增溶剂进行消化。通过检测细胞放射性来确定示踪元素的导入。细胞培养条件:培养时间为30 min,培养温度37 ℃,二肽及二肽组成氨基酸的浓度均为10 mmol/l。
1.4 统计
所有分析(线性或非线性回归分析)均用Prism2.01完成,数据以平均值±标准误(SEM)表示,差异显著性用Student t检验。
2 结果与分析
2.1 Caco-2细胞中L-[3H]Arg和L-[3H]Ala的转运特点(见图1、图2)
A



氨基酸转运试验是在pH值7.4条件下进行的,以降低H+依赖转运体系对氨基酸吸收的影响。无论是否有Na+的参与,在10 mmol/l L-Arg试验组中,5 μmol/l 有放射性标记的酸性 L-[3H]Arg吸收率都下降到对照组的7% (见图1A)。在Na+参与下,10 mmol/l L-Ala试验组与对照组相比,5 μmol/l 有放射标记的酸性 L-[3H]Arg吸收率下降了83%(见图1A);在既无L-Arg又无L-Ala底物的对照组中,在无Na+参与时5 μmol/l L-[3H]Arg的吸收率是有Na+的条件下的2倍(见图1A)。无Na+参与下,酸性氨基酸(如L-Lys)吸收率更高,这是由于电敏感机制引起的,该机制会受到Na+的抑制。L-Ala(10 mmol/l)降低了非依赖Na+ L-[3H]Arg 吸收率的85%,这表明氨基酸的移动是由b0,+系统转运的,该系统可在无Na+的条件下转运酸性、中性氨基酸。15%的L-[3H]Arg吸收是不受L-Ala的影响,而是由Y+系统(不依赖Na+可转运酸性氨基酸)转运或者是由Y+L系统(在无Na+的条件下转运酸性氨基酸,在有Na+的条件下转运中性氨基酸)转运。
为评定L-Arg的吸收是否被这两种转运通道所调节,我们作出了一个流速与底物浓度间的函数图。转运率表示饱和动力学(见图1B),速率的变化表示相关性的高低,这两种转运通道的Km值分别是(182.3±24.4) μmol/l、(34.9±2.2) μmol/l(见图1B)。
L-[3H]Ala转运到Caco-2细胞主要受转运系统的调节而不受L-[3H]Arg吸收的影响。无Na+参与下,L-[3H]Ala的转运仅是有Na+条件下的一半(见图2A)。无Na+条件下,10 mmol/l L-Arg抑制了30%的L-[3H]Ala吸收(见图2A)。在有Na+条件下,L-[3H]Ala的吸收是无Na+条件下的2倍,这是由于Na+存在时,b0,+系统转运了15% L-Ala。研究表明,几种转运系统均参与了L-Ala的吸收转运,L-[3H]Ala速率动力学显示Km值基本是一常数,约为150 μmol/l(见图2B),这也说明参与 L-Ala吸收转运的不同转运系统的Km值基本相同。
2.2 二肽和游离氨基酸处理过的Caco-2细胞对L-[3H]Ala、L-[3H]Arg流速的影响
二肽浓度不断升高的情况下,测量5 μmol/l D-[3H]Phe-L-Ala吸收率,从而研究二肽与PEPT1的相关性(见图3)。EC50值分别是:L-Lys-L-Lys为(411.1±15.3) μmol/l,Gly-L-Arg为(412.7±13.7) μmol/l,Gly-L-His为(42.0±6.5) μmol/l,L-Ala-L-Ala为(271.3±12.4) μmol/l(见图3)。上述任一种二肽浓度为10 mmol/l时,转运系统的转运速度均达最大值Vmax。在前处理过程中,分别用10 mmol/l L-Lys-L-Lys、Gly-L-Arg、Gly-L-His 、L-Ala-L-Ala 培养Caco-2细胞;同时用同摩尔浓度的氨基酸(二肽的组成氨基酸)进行预培养,并比较二肽与游离氨基酸转运系统间的影响作用。阴性对照(底物为10 mmol/l Gly-Gly或20 mmol/l Gly)说明b0,+系统对L-[3H]Arg吸收的影响,然后计算L-[3H]Arg(50 Ci/mmol)和L-[3H]Ala进入Caco-2细胞的速度。

除了Gly(无论是以二肽形式还是以游离形式)外,其它任一种前培养方式均明显提高了Caco-2细胞对L-[3H]Arg的吸收速度(见表1)。用二肽培养后的吸收速度较氨基酸的快,二肽与氨基酸混合物培养后吸收速度最快。用Gly-L-Arg、Gly、L-Arg混合物或L-Ala-L-Ala、L-Ala混合物前培养Caco-2细胞后,L-[3H]Arg的吸收速度提高了4.6倍(见表1)。与L-[3H]Arg转运相反,用L-Ala-L-Ala、Gly-L-Arg、L-Lys-L-Lys 或其组成氨基酸或二肽与氨基酸的混合物培养Caco-2细胞后,L-[3H]Ala的吸收速度均没有显著提高(见表2)。


2.3 二肽胞内水解促进L-[3H]Arg吸收
以下试验证明了二肽胞内水解是L-[3H]Ala的吸收前提条件:①非水解的D-Phe-L-Ala 不能促进L-[3H]Ala的转运(见表3);②先用氨肽酶抑制剂(Amastatin)前处理细胞以抑制胞内水解,然后再与Gly-L-Arg进行前培养抑制胞外水解后,不能促进转运(见表3)。Amastatin广泛用作肽水解抑制剂,且其不会干扰上皮细胞肽转运系统,因此Amastatin是通过抑制Gly-L-Arg的水解阻碍Gly-L-Arg的吸收。细胞经游离氨基酸前处理后,Amastatin不能影响细胞跨膜转运,这也说明了Amastatin对水解的特殊作用(见表3)。

L-[3H]Arg吸收的限速步骤是二肽转运到细胞还是二肽胞内水解呢?试验证明,限速步骤是转运而不是水解(见图4)。通过Gly-L-Arg或L-Lys-L-Lys前处理细胞试验发现L-Arg流速达1/2 Vmax时Gly-L-Arg是(489.7±46.8) μmol/l,L-Lys-L-Lys是(534.7±26.3) μmol/l (见图4)。L-[3H]Arg 跨膜转运EC50值的大小相似于同PEPT1作用的肽的引力(见图3)。

3 讨论
小肠中氨态氮吸收既以游离形式,又以二肽、三肽的形式,但不同的转运系统对氨基酸吸收影响程度尚不明确。以往试验没有在细胞水平研究氨基酸和二肽吸收的相互作用,因这种研究适宜于在类似提取细胞的组织环境下进行。本试验选用的是Caco-2细胞。
通过Caco-2细胞研究试验,证明了二肽转运和酸性氨基酸转运间的相互作用。酸性L-Lys受到两种转运系统的调节,一个是非依赖Na+酸性、中性氨基酸转运系统,另一个是特定氨基酸转运系统。在以前研究中,第一个系统即b0,+系统能转运47%L-Lys,特定酸性氨基酸转运系统Y+转运27%,浓度差转运26%。64%是由载体转运系统b0,+转运,36%由系统Y+转运。在本次研究中,L-[3H]Arg 85%由系统b0,+调节,15%由系统Y+调节。经系统b0,+转运L-Arg的比率更高,原因是细胞不同、生长因子不同。
酸性、中性氨基酸吸收必须要有系统b0,+转运,对L-Ala吸收比依赖Na+转运低15%。在Na+存在下,转运中性、酸性氨基酸的b0,+系统只转运L-Ala 吸收总量的35%。b0,+转运系统仍未在肠道组织分子水平上得以证实。原名为NBB转运系统更名为系统b,能更好地反映出与系统b0,+的关系。
显然,与L-Arg及其转运系统相反,L-Ala的流速不受前培养物(无论是酸性、中性氨基酸还是二肽)的影响。15%L-Ala吸收量是系统b0,+转运,内源氨基酸不能显著影响L-Ala流速。
本次试验第一次在细胞水平证实小肽与游离氨基酸吸收之间相互作用,并为PEPT1对氨基酸吸收的调节作用提供了证据。小肽转运系统可转运400多种二肽和8 000种三肽,能显著改善肠道游离氨基酸的转运。PEPT1可转运大量小肽到肠道上皮细胞,这些小肽水解后释放出游离氨基酸,从而促进必需氨基酸如L-Arg、L-Lys的吸收。小肽转运系统能促进肠道氨基酸的吸收。首先,二肽、三肽(含有必需氨基酸)的转运避免了必需氨基酸参与氨基酸转运系统的竞争;其次,由于增加细胞内游离氨基酸含量,从而能促进必需氨基酸的吸收。
(编辑:刘敏跃,lm-y@tom.com)
马小珍,福建出入境检验检疫局,850001,福州市湖东路312号。
薛晓生、王碧莲、周围、姚雄军,华达生化科技饲料(湖北)有限公司。
收稿日期:2007-01-23
注:译自细胞生理学杂志,2001(186):251~259





