王 燕 汪以真
摘 要 抗菌肽广泛存在于自然界,是动物先天免疫的重要组成成分。PR-39是其中一类由39个氨基酸残基构成的多肽。文章综述了PR-39在结构、基因表达及其调控、作用机理及生物学活性等方面的研究进展,并对其应用前景进行了展望。
关键词 抗菌肽;PR-39;基因表达;作用机理
中图分类号 S816.79
抗菌肽作为存在于生物体内一类具有广谱抗菌活性的多肽,是宿主非特异性防御系统的重要组成部分,在动物先天免疫机制中具有特殊的意义。目前,在哺乳动物体内发现的10余种具有抗菌活性的肽类都属于defensins(防御素)和cathelicidins两大家族[1]。PR-39是cathelicidins家族中一类富含脯氨酸和精氨酸的多肽,由39个氨基酸残基组成,分子量为4 719.7D,具有广谱的抗革兰氏阳性和阴性菌,抗真菌等生物学功能。
1 PR-39的结构
1.1 PR-39的氨基酸结构
猪抗菌肽PR-39由Agerberth[2]等人于1991年最先从猪小肠组织中分离纯化出来。经氨基酸序列分析,PR-39一级结构中富含脯氨酸(Pro)、精氨酸(Arg)两种氨基酸残基,其中19个脯氨酸、10个精氨酸,故称其为PR-39(Proline-arginine-rich)。其余氨基酸残基分别为苯丙氨酸、亮氨酸、酪氨酸、异亮氨酸和甘氨酸,其氨基酸排列顺序为:RRRPR PPYLP RPRPP PFFPP RLPPR IPPGF PPRFP PRFP。在其结构中,脯氨酸和精氨酸构成的Pro-Arg-Pro结构可能与细菌磷脂膜的相互作用有关[2]。经圆二色谱和傅立叶变换红外光谱分析,PR-39在水溶液中并不像其它抗菌肽那样形成α螺旋或β折叠,而是呈伸展性螺旋构象,这可能与其脯氨酸含量有关[3]。
1.2 PR-39的基因结构
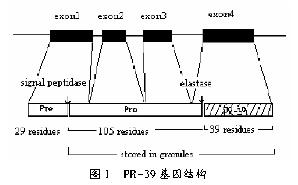
抗菌肽PR-39前体是一条编码173个氨基酸残基的基因,其基因结构相当紧凑,仅由1 784bp组成,具有4个外显子和3个内含子(图1)[4]。第一个外显子表达信息序列(Pre)的29个残基和cathelin前导部分(Pro)的37个成熟肽,外显子2和3仅包含cathelin蛋白信息,外显子4编码cathelin的4个C-端残基和PR-39的成熟肽。在Pre和Pro之间有一个信号肽酶识别位点,可被信号肽酶识别从而切除信号肽。对cathelicidin抗菌肽家族来说,Pro是以一段非常保守的区域,氨基酸数目一般在99~114范围之间变动。Pro和PR-39成熟肽之间还有一个胰肽酶E(elastase)的识别位点,这与PR-39从细胞内的释放并发挥生物学功能相关。另外,整个基因结构中有HindⅢ、SmaⅠ、EcoRⅠ等多个酶切位点,显示了多种限制性片断多态性。
2 PR-39的基因表达及其调控
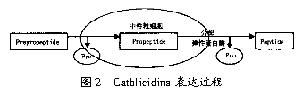
大部分cathlicidins的表达是在骨髓细胞分化的过程中进行的。因此,在成熟的嗜中性粒细胞中很难找到它们的mRNA。编码的cathlicidins在信号肽的引导下进入细胞,然后信号肽切除,剩下的部分叫做proform或者propeptide。这部分通常没有抗菌活性,原因可能是带有阴离子的Pro片段抑制了C-端的阳离子,使后者不能发挥其活性,同时这一作用也可以避免肽的细胞内毒性。Cathlicidins就以这种形式储存在颗粒体中,当有来自嗜苯胺颗粒体的蛋白酶作用于proform时,其中的抗菌域片段就被切割下来,成熟的抗菌肽就得以分泌。整个过程如图2所示。
2.1 PR-39 的基因表达
Wu 等1999年研究显示,PR-39基因表达有组织特异性。在各生长阶段,猪骨髓中都能检测到mRNA表达。幼龄仔猪外周血中嗜中性粒细胞也能表达PR-39 mRNA,但在42d后就检测不到;在4周龄前,仔猪的肾、肝和一些淋巴器官,包括胸腺、脾脏和肠系膜淋巴结也都能表达PR-39 mRNA,然而4周龄后,却检测不到PR-39 mRNA。随日龄增长,这些器官和组织中PR-39基因表达受到抑制,可能反映出新生仔猪不成熟嗜中性粒细胞的数目比成年猪多[5]。
2.2 PR-39基因表达的调控
目前的研究揭示,在PR-39基因序列启动子区域有发挥TATA box功能的TAAA序列,并且该区域还存在多个潜在的转录调控因子识别位点,如:核因子白介素-6(NF-IL-6)、白介素-6应答元件(IL-6-RE)、SP-1、AP-2等,这些转录调控因子可以调节PR-39的基因的表达。Wu等进行了脂多糖(LPS)、白介素-6(IL-6)、视黄酸(RA)处理培养的骨髓原代细胞的体外实验,检测这些物质对猪骨髓细胞cathelicidin抗菌肽家族中抗菌肽PR-39和protegrin表达的影响,又研究了猪在感染肠道沙门氏菌情况下PR-39基因表达情况的体内实验[6]。体外实验结果发现,脂多糖处理后,PR-39 mRNA表达水平显著上升,其骨髓细胞培养上清液中PR-39浓度也显著增加,表明LPS不仅在转录水平促进PR-39表达,也在翻译水平促进其表达,而多粘菌素B则有增强LPS促进PR-39表达的作用。与此相似,白介素-6和视黄酸也能诱导cathelicidin基因显著表达,增强PR-39启动子-荧光素酶表达子转染后PK-15细胞内荧光素酶活性。体内实验结果发现,猪被感染沙门氏菌6h和24h后,其骨髓中PR-39和protegrin mRNA表达增加。这些结果都表明,细菌(如沙门氏菌)、细菌分解产物脂多糖、细胞因子IL-6和微量营养视黄酸均能增强PR-39和protegrin在骨髓原代细胞中的表达,原因极可能就在于这些物质直接或间接激活了PR-39基因启动子,从而加强其表达。这预示了通过体外添加某些物质来调控PR-39基因表达将成为可能。Huawu和Christopher等研究显示,PR-39基因5'端转录起始位点前第69~63核苷酸存在一个反向调控元件(negative regulatory element)。通过基因点突变揭示ATG在其中起主要作用,而ATG是一个起始密码子,由此猜测PR-39基因5'端转录起始位点前一段开发阅读框架编码一种肽,参与反向调控PR-39的表达[7]。
3 PR-39的作用机理
1993年Boman等[8]研究发现PR-39发挥抗菌作用时并不形成孔道,不裂解细菌,而是通过抑制细胞内DNA和蛋白质的合成来杀灭细菌。比较杀菌肽(cecropin P1)和PR-39抗大肠杆菌作用时间后发现,杀菌肽能迅速裂解细菌,而PR-39需8min穿膜,然后快速地杀灭细菌,而且与杀菌肽相比,PR-39对处于对数生长期细菌要比对处于非对数生长期细菌的杀伤作用迅速而明显。Shi等用扫描电镜观察证明,PR-39与细胞作用时并没有在膜上形成孔道[9]。目前已知PR-39依靠精氨酸残基的正电荷与细菌细胞磷脂膜之间形成静电引力作用后吸附在细胞膜上,然而至于其如何透过脂质双层进入细胞内,从而抑制DNA和蛋白质合成的确切机制尚不清楚。另外,PR-39对中性粒细胞的趋化作用,即调控中性粒细胞在感染部位聚集,促进其对病原体的吞噬,可能也是PR-39抗菌作用的一个方面。
4 PR-39的生物学活性
4.1 抗细菌、真菌活性
猪抗菌肽PR-39的抗菌作用主要是针对革兰氏阴性菌,对部分革兰氏阳性菌也有抗菌效果。Agerberth等[2]用分离纯化得到的PR-39作抗菌分析,发现PR-39能明显抑制大肠杆菌、鼠伤寒沙门氏菌和醋酸钙不动杆菌等4种革兰氏阴性菌,对巨大芽孢杆菌和化脓链球菌也能产生抑菌效果,而对其它一些菌株如普通变形杆菌、铜绿假单孢菌和金黄色葡萄球菌即使在200~300μM下也没有抑制作用[10]。用合成的PR-39作抗菌试验,也有类似的结果[4],Delfino等研究发现,PR-39能显著地降低新生小鼠感染E. coli后的死亡率[11]。并且PR-39对从临床分离的药物敏感且具有许多耐药性的肺结核分支杆菌有抗菌作用[12,13]。
4.2 对PMNs具有趋化作用
Huang 等[14]报道,PR-39能诱导嗜中性粒细胞的定向迁移,但是对单核细胞没有趋化作用;并发现对嗜中性粒细胞趋化作用的结构域可能是前端的26个氨基酸片断。在细胞外没有Ca2+存在时,PR-39不能发挥其趋化作用;百日咳毒素可以抑制嗜中性粒细胞的趋化作用和Ca2+的动员。所以认为PR-39是Ca2+依赖性的嗜中性粒细胞的趋化剂。此作用也表明了PR-39在炎症反应中发挥的重要作用[15]。
4.3 促进伤口恢复
PR-39可以聚集和诱导细胞表面多配体聚糖(syndecan)-1和(syndecan)-4的表达,该糖是参与病理修复重要的类肝素硫蛋白聚糖。Gallo 等[16]实验发现,PR-39在伤口处通过细胞渗透被释放,然后诱导多配体聚糖的表达并裂解细菌。PR-39的抗菌活性和诱导多配体聚糖活性是非常有助于伤口的恢复的。
4.4 抗癌作用
PR-39能抑制人肝癌细胞的入侵及迁移。有研究表明PR-39可以诱导syndecan-1的合成,而在人肝癌细胞中syndecan-1的表达量减少,因此推测syndecan-1在抑制肿瘤细胞的入侵和转移中发挥重要的作用。Ohtake 等[17]研究表明,PR-39具有抑制人肝癌细胞中肌动蛋白结构的改变和能动活性的功能,并且还能抑制肿瘤细胞的入侵,可能是因为PR-39对syndecan-1有诱导作用。
4.5 减缓病理损伤
PR-39通过结合p47phox的SH3结构域,强烈地抑制吞噬细胞NADPH氧化酶复合物的装配,使活性氧类物质(ROS)的产生受到抑制,从而间接地减轻组织病理损伤[9,18]。作为NADPH氧化酶的抑制物,在离体灌注鼠肺中PR-39可以抑制由局部缺血和高K+引起ROS的产生[19]。
5 应用前景
5.1 取代抗生素
随着传统抗生素广泛、长期的应用,许多病原菌对其产生了耐药性。而PR-39等抗菌肽的抗菌机制不同于传统的抗生素,不易产生耐药菌株,在医药业上具有广阔的前景。因此,随着对抗菌肽结构与活性关系及作用机制的深入研究,将抗菌肽作为抗生素替代品是可行的。
5.2 转基因研究及应用
仔猪腹泻、奶牛乳房炎及各种病毒性疾病一直影响畜牧业的发展。随着分子生物学及基因工程技术的发展,抗菌肽的转基因工程也取得了一些进展,我们可以借鉴已成功的抗菌肽转基因工程,如转基因蚊子、转基因小鼠、转基因水稻等,把PR-39等抗菌肽基因转入畜禽特定的细胞让其表达,培育出抗病新品种,这将会极大地推动畜牧业的发展。
5.3 饲料添加剂研究
抗生素添加剂的使用严重破坏了动物肠道的微生物平衡,并易在动物体内残留,严重影响了畜产品的品质和人类的。抗菌肽作为宿主先天免疫防御中存在的古老又保守的一类蛋白分子,具有独特的抗菌机制,人畜食后易被体内的蛋白酶水解消化,无毒副作用。因此,用化学合成法和基因工程的方法生产安全、环保型的PR-39等抗菌肽饲料添加剂具有广阔的前景。
5.4 营养物质调控PR-39的基因表达
已有研究表明,在PR-39基因的5′端启动子区域包含有IL-6等转录因子的结合位点[20,21],进一步说明可以通过营养物质对其基因表达进行调控,达到增强动物的先天免疫力、提高动物早期抗病能力的目的。 参考文献
1 Ramanathan B,Davis EG,Ross CR,et al.Cathelicidins:microbicidal activity,mechanism of action,and roles in innate immunity[J].Microbes and Infection,2002,4(3):361~372
2 Agerberth B, Lee JY, Bergman T, et al.Amino acid sequence of PR-39: Isolation from pig intestine of a new member of the family of proline-arginine-rich antibacterial peptides[J]. Eur.J.Biochem, 1991(202): 849~854
3 Cabiaux V, Agerberth B, Johansson J, et al. Secondary structure and membrane interaction of PR-39, a Pro+Arg-rich antibacterial peptide[J]. Eur. J. Biochem., 1994(224): 1 019~1 027
4 Gudmundsson G H, Magnusson K P, Chowdhary B P, et al. Structure of the Gene for Porcine Peptide Antibiotic PR-39, a Cathelin Gene Family Member: Comparative Mapping of the Locus for the Human Peptide Antibiotic FALL-39[J]. Proc. Natl Acad. Sci. USA., 1995, 92: 7 085~7 089
5 Wu H, Zhang G, Chrestopher R, et al. Cathelicidin gene expression in procine tissues: Roles in ontogeny and tissue specificity[J]. Infection and Immunity, 1999, 67: 439~442
6 Wu H, Zhang G, Minton J E. Regulation of cathelicidin gene expression: induction by lipopolysaccharide, interleukin-6, retinoic acid, and salmonella enterica serovar typhimurium infection[J].Infection and Immunity, 2000,68: 5 552~5 558
7 Shimazaki K. Separation and Utilization of bovine lactoferrin[J]. Japanese Journal of Dairy and Food Science.,1989, 38: 277~283
8 Boman H G, Agerberth B, Boman A. Mechanisms of action on Escherichia coli of cecropin P1 and PR-39, two antibacterial peptides from pig intestine[J]. Infect. Immun., 1993, 61:2 978~2 984
9 Shi J, Ross C R, Leto T L, et al.PR-39, a proline-rich antibacterial peptide that inhibits phagocyte NADPH oxidase activity by binding to Src homology 3 domains of p47 phox[J]. Proc Natl Acad Sci USA., 1996, 93: 6 014~6 018
10 Andrea G, Oscar C, Francosco I, et al. Antimicrobial activity of polycationic peptides[J]. Peptides, 1999, 20: 1 263~1 273
11 Delfino D, Cusumano VV, Tomasello F, et al. Beneficial effects of antibacterial peptide PR-39 in a neonatal murine model of endotoxic shock[J]. New Microbiol, 2004, 27(4): 369~374
12 Linde CM, Hoffner SE, Refai E, et al. In vitro activity of PR-39, a praline - arginine -rich peptide, against susceptible and multi-drug-resistant Mycobacterium tuberculosis[J]. J. Antimicrob. Chemother, 2001,47:575~580
13 Phillip H. A. Lee, Takaaki Ohtake, Mohamed Zaiou, et al. Expression of an additional cathelicidin antimicrobial peptide protects against bacterial skin infection [J]. PNAS, 2005,102(10):3 750~3 755
14 Huang H., Ross C.R., Blecha F. Chemoattractant properties of PR-39, a neutrophil antibacterial peptide[J].J. Leukoc. Biol. 1997,61:624~629
15 Ramanathan B, Wu H, Ross CR, et al. PR-39, a porcine antimicrobial peptide, inhibits apoptosis: involvement of caspase-3[J]. Dev Comp Immunol, 2004,28(2):163~169
16 Gallo R.L., Ono M., Povsic T., et al. Syndecans, cell surface heparan sulfate proteoglycans, are induced by a proline-rich antimicrobial peptide from wounds[J]. Proc. Natl Acad. Sci. USA. 1994,91:11 035~11 039
17 Ohtake T., Fujimoto Y., Ikuta K., et al. Proline-rich antimicrobial peptide, PR-39 gene transduction altered invasive activity and actin structure in human hepatocellular carcinoma cells[J]. Br. J. Cancer, 1999,81:393~403
18 James PE, M Madhani, Ross C, et al. Tissue hypoxia during bacterial sepsis is attenuated by PR-39, an antibacterial peptide[J]. Adv Exp Med Biol, 2003, 530: 645~652
19 Al-Mehdi A.B., Zhao G., Dodia C., et al.Endothelial NADPH Oxidase as the source of oxidants in lungs exposed to ischemia or high K+[J]. Circ. Res. 1998,83:730~737
20 Robert EW,Hancock,Gil D.The role of cationic anirimicrobial peptides in innate host defences[J].Trends in Microbiology,2000,8:4 021
21 汪以真,韩新燕,许梓荣.哺乳动物抗菌肽及其在畜牧生产上应用前景[J].中国畜牧杂志,2002,38:52
(编辑:张学智,mengzai007@163.com)
王燕,浙江大学动物分子营养学教育部重点实验室,310029,浙江大学饲料科学研究所。
汪以真,单位及通讯地址同第一作者。
收稿日期:2006-03-27
★ 国家基金课题(NO.30571348)资助项目 健康
摘 要 抗菌肽广泛存在于自然界,是动物先天免疫的重要组成成分。PR-39是其中一类由39个氨基酸残基构成的多肽。文章综述了PR-39在结构、基因表达及其调控、作用机理及生物学活性等方面的研究进展,并对其应用前景进行了展望。
关键词 抗菌肽;PR-39;基因表达;作用机理
中图分类号 S816.79
抗菌肽作为存在于生物体内一类具有广谱抗菌活性的多肽,是宿主非特异性防御系统的重要组成部分,在动物先天免疫机制中具有特殊的意义。目前,在哺乳动物体内发现的10余种具有抗菌活性的肽类都属于defensins(防御素)和cathelicidins两大家族[1]。PR-39是cathelicidins家族中一类富含脯氨酸和精氨酸的多肽,由39个氨基酸残基组成,分子量为4 719.7D,具有广谱的抗革兰氏阳性和阴性菌,抗真菌等生物学功能。
1 PR-39的结构
1.1 PR-39的氨基酸结构
猪抗菌肽PR-39由Agerberth[2]等人于1991年最先从猪小肠组织中分离纯化出来。经氨基酸序列分析,PR-39一级结构中富含脯氨酸(Pro)、精氨酸(Arg)两种氨基酸残基,其中19个脯氨酸、10个精氨酸,故称其为PR-39(Proline-arginine-rich)。其余氨基酸残基分别为苯丙氨酸、亮氨酸、酪氨酸、异亮氨酸和甘氨酸,其氨基酸排列顺序为:RRRPR PPYLP RPRPP PFFPP RLPPR IPPGF PPRFP PRFP。在其结构中,脯氨酸和精氨酸构成的Pro-Arg-Pro结构可能与细菌磷脂膜的相互作用有关[2]。经圆二色谱和傅立叶变换红外光谱分析,PR-39在水溶液中并不像其它抗菌肽那样形成α螺旋或β折叠,而是呈伸展性螺旋构象,这可能与其脯氨酸含量有关[3]。
1.2 PR-39的基因结构
抗菌肽PR-39前体是一条编码173个氨基酸残基的基因,其基因结构相当紧凑,仅由1 784bp组成,具有4个外显子和3个内含子(图1)[4]。第一个外显子表达信息序列(Pre)的29个残基和cathelin前导部分(Pro)的37个成熟肽,外显子2和3仅包含cathelin蛋白信息,外显子4编码cathelin的4个C-端残基和PR-39的成熟肽。在Pre和Pro之间有一个信号肽酶识别位点,可被信号肽酶识别从而切除信号肽。对cathelicidin抗菌肽家族来说,Pro是以一段非常保守的区域,氨基酸数目一般在99~114范围之间变动。Pro和PR-39成熟肽之间还有一个胰肽酶E(elastase)的识别位点,这与PR-39从细胞内的释放并发挥生物学功能相关。另外,整个基因结构中有HindⅢ、SmaⅠ、EcoRⅠ等多个酶切位点,显示了多种限制性片断多态性。

2 PR-39的基因表达及其调控
大部分cathlicidins的表达是在骨髓细胞分化的过程中进行的。因此,在成熟的嗜中性粒细胞中很难找到它们的mRNA。编码的cathlicidins在信号肽的引导下进入细胞,然后信号肽切除,剩下的部分叫做proform或者propeptide。这部分通常没有抗菌活性,原因可能是带有阴离子的Pro片段抑制了C-端的阳离子,使后者不能发挥其活性,同时这一作用也可以避免肽的细胞内毒性。Cathlicidins就以这种形式储存在颗粒体中,当有来自嗜苯胺颗粒体的蛋白酶作用于proform时,其中的抗菌域片段就被切割下来,成熟的抗菌肽就得以分泌。整个过程如图2所示。

2.1 PR-39 的基因表达
Wu 等1999年研究显示,PR-39基因表达有组织特异性。在各生长阶段,猪骨髓中都能检测到mRNA表达。幼龄仔猪外周血中嗜中性粒细胞也能表达PR-39 mRNA,但在42d后就检测不到;在4周龄前,仔猪的肾、肝和一些淋巴器官,包括胸腺、脾脏和肠系膜淋巴结也都能表达PR-39 mRNA,然而4周龄后,却检测不到PR-39 mRNA。随日龄增长,这些器官和组织中PR-39基因表达受到抑制,可能反映出新生仔猪不成熟嗜中性粒细胞的数目比成年猪多[5]。
2.2 PR-39基因表达的调控
目前的研究揭示,在PR-39基因序列启动子区域有发挥TATA box功能的TAAA序列,并且该区域还存在多个潜在的转录调控因子识别位点,如:核因子白介素-6(NF-IL-6)、白介素-6应答元件(IL-6-RE)、SP-1、AP-2等,这些转录调控因子可以调节PR-39的基因的表达。Wu等进行了脂多糖(LPS)、白介素-6(IL-6)、视黄酸(RA)处理培养的骨髓原代细胞的体外实验,检测这些物质对猪骨髓细胞cathelicidin抗菌肽家族中抗菌肽PR-39和protegrin表达的影响,又研究了猪在感染肠道沙门氏菌情况下PR-39基因表达情况的体内实验[6]。体外实验结果发现,脂多糖处理后,PR-39 mRNA表达水平显著上升,其骨髓细胞培养上清液中PR-39浓度也显著增加,表明LPS不仅在转录水平促进PR-39表达,也在翻译水平促进其表达,而多粘菌素B则有增强LPS促进PR-39表达的作用。与此相似,白介素-6和视黄酸也能诱导cathelicidin基因显著表达,增强PR-39启动子-荧光素酶表达子转染后PK-15细胞内荧光素酶活性。体内实验结果发现,猪被感染沙门氏菌6h和24h后,其骨髓中PR-39和protegrin mRNA表达增加。这些结果都表明,细菌(如沙门氏菌)、细菌分解产物脂多糖、细胞因子IL-6和微量营养视黄酸均能增强PR-39和protegrin在骨髓原代细胞中的表达,原因极可能就在于这些物质直接或间接激活了PR-39基因启动子,从而加强其表达。这预示了通过体外添加某些物质来调控PR-39基因表达将成为可能。Huawu和Christopher等研究显示,PR-39基因5'端转录起始位点前第69~63核苷酸存在一个反向调控元件(negative regulatory element)。通过基因点突变揭示ATG在其中起主要作用,而ATG是一个起始密码子,由此猜测PR-39基因5'端转录起始位点前一段开发阅读框架编码一种肽,参与反向调控PR-39的表达[7]。
3 PR-39的作用机理
1993年Boman等[8]研究发现PR-39发挥抗菌作用时并不形成孔道,不裂解细菌,而是通过抑制细胞内DNA和蛋白质的合成来杀灭细菌。比较杀菌肽(cecropin P1)和PR-39抗大肠杆菌作用时间后发现,杀菌肽能迅速裂解细菌,而PR-39需8min穿膜,然后快速地杀灭细菌,而且与杀菌肽相比,PR-39对处于对数生长期细菌要比对处于非对数生长期细菌的杀伤作用迅速而明显。Shi等用扫描电镜观察证明,PR-39与细胞作用时并没有在膜上形成孔道[9]。目前已知PR-39依靠精氨酸残基的正电荷与细菌细胞磷脂膜之间形成静电引力作用后吸附在细胞膜上,然而至于其如何透过脂质双层进入细胞内,从而抑制DNA和蛋白质合成的确切机制尚不清楚。另外,PR-39对中性粒细胞的趋化作用,即调控中性粒细胞在感染部位聚集,促进其对病原体的吞噬,可能也是PR-39抗菌作用的一个方面。
4 PR-39的生物学活性
4.1 抗细菌、真菌活性
猪抗菌肽PR-39的抗菌作用主要是针对革兰氏阴性菌,对部分革兰氏阳性菌也有抗菌效果。Agerberth等[2]用分离纯化得到的PR-39作抗菌分析,发现PR-39能明显抑制大肠杆菌、鼠伤寒沙门氏菌和醋酸钙不动杆菌等4种革兰氏阴性菌,对巨大芽孢杆菌和化脓链球菌也能产生抑菌效果,而对其它一些菌株如普通变形杆菌、铜绿假单孢菌和金黄色葡萄球菌即使在200~300μM下也没有抑制作用[10]。用合成的PR-39作抗菌试验,也有类似的结果[4],Delfino等研究发现,PR-39能显著地降低新生小鼠感染E. coli后的死亡率[11]。并且PR-39对从临床分离的药物敏感且具有许多耐药性的肺结核分支杆菌有抗菌作用[12,13]。
4.2 对PMNs具有趋化作用
Huang 等[14]报道,PR-39能诱导嗜中性粒细胞的定向迁移,但是对单核细胞没有趋化作用;并发现对嗜中性粒细胞趋化作用的结构域可能是前端的26个氨基酸片断。在细胞外没有Ca2+存在时,PR-39不能发挥其趋化作用;百日咳毒素可以抑制嗜中性粒细胞的趋化作用和Ca2+的动员。所以认为PR-39是Ca2+依赖性的嗜中性粒细胞的趋化剂。此作用也表明了PR-39在炎症反应中发挥的重要作用[15]。
4.3 促进伤口恢复
PR-39可以聚集和诱导细胞表面多配体聚糖(syndecan)-1和(syndecan)-4的表达,该糖是参与病理修复重要的类肝素硫蛋白聚糖。Gallo 等[16]实验发现,PR-39在伤口处通过细胞渗透被释放,然后诱导多配体聚糖的表达并裂解细菌。PR-39的抗菌活性和诱导多配体聚糖活性是非常有助于伤口的恢复的。
4.4 抗癌作用
PR-39能抑制人肝癌细胞的入侵及迁移。有研究表明PR-39可以诱导syndecan-1的合成,而在人肝癌细胞中syndecan-1的表达量减少,因此推测syndecan-1在抑制肿瘤细胞的入侵和转移中发挥重要的作用。Ohtake 等[17]研究表明,PR-39具有抑制人肝癌细胞中肌动蛋白结构的改变和能动活性的功能,并且还能抑制肿瘤细胞的入侵,可能是因为PR-39对syndecan-1有诱导作用。
4.5 减缓病理损伤
PR-39通过结合p47phox的SH3结构域,强烈地抑制吞噬细胞NADPH氧化酶复合物的装配,使活性氧类物质(ROS)的产生受到抑制,从而间接地减轻组织病理损伤[9,18]。作为NADPH氧化酶的抑制物,在离体灌注鼠肺中PR-39可以抑制由局部缺血和高K+引起ROS的产生[19]。
5 应用前景
5.1 取代抗生素
随着传统抗生素广泛、长期的应用,许多病原菌对其产生了耐药性。而PR-39等抗菌肽的抗菌机制不同于传统的抗生素,不易产生耐药菌株,在医药业上具有广阔的前景。因此,随着对抗菌肽结构与活性关系及作用机制的深入研究,将抗菌肽作为抗生素替代品是可行的。
5.2 转基因研究及应用
仔猪腹泻、奶牛乳房炎及各种病毒性疾病一直影响畜牧业的发展。随着分子生物学及基因工程技术的发展,抗菌肽的转基因工程也取得了一些进展,我们可以借鉴已成功的抗菌肽转基因工程,如转基因蚊子、转基因小鼠、转基因水稻等,把PR-39等抗菌肽基因转入畜禽特定的细胞让其表达,培育出抗病新品种,这将会极大地推动畜牧业的发展。
5.3 饲料添加剂研究
抗生素添加剂的使用严重破坏了动物肠道的微生物平衡,并易在动物体内残留,严重影响了畜产品的品质和人类的。抗菌肽作为宿主先天免疫防御中存在的古老又保守的一类蛋白分子,具有独特的抗菌机制,人畜食后易被体内的蛋白酶水解消化,无毒副作用。因此,用化学合成法和基因工程的方法生产安全、环保型的PR-39等抗菌肽饲料添加剂具有广阔的前景。
5.4 营养物质调控PR-39的基因表达
已有研究表明,在PR-39基因的5′端启动子区域包含有IL-6等转录因子的结合位点[20,21],进一步说明可以通过营养物质对其基因表达进行调控,达到增强动物的先天免疫力、提高动物早期抗病能力的目的。 参考文献
1 Ramanathan B,Davis EG,Ross CR,et al.Cathelicidins:microbicidal activity,mechanism of action,and roles in innate immunity[J].Microbes and Infection,2002,4(3):361~372
2 Agerberth B, Lee JY, Bergman T, et al.Amino acid sequence of PR-39: Isolation from pig intestine of a new member of the family of proline-arginine-rich antibacterial peptides[J]. Eur.J.Biochem, 1991(202): 849~854
3 Cabiaux V, Agerberth B, Johansson J, et al. Secondary structure and membrane interaction of PR-39, a Pro+Arg-rich antibacterial peptide[J]. Eur. J. Biochem., 1994(224): 1 019~1 027
4 Gudmundsson G H, Magnusson K P, Chowdhary B P, et al. Structure of the Gene for Porcine Peptide Antibiotic PR-39, a Cathelin Gene Family Member: Comparative Mapping of the Locus for the Human Peptide Antibiotic FALL-39[J]. Proc. Natl Acad. Sci. USA., 1995, 92: 7 085~7 089
5 Wu H, Zhang G, Chrestopher R, et al. Cathelicidin gene expression in procine tissues: Roles in ontogeny and tissue specificity[J]. Infection and Immunity, 1999, 67: 439~442
6 Wu H, Zhang G, Minton J E. Regulation of cathelicidin gene expression: induction by lipopolysaccharide, interleukin-6, retinoic acid, and salmonella enterica serovar typhimurium infection[J].Infection and Immunity, 2000,68: 5 552~5 558
7 Shimazaki K. Separation and Utilization of bovine lactoferrin[J]. Japanese Journal of Dairy and Food Science.,1989, 38: 277~283
8 Boman H G, Agerberth B, Boman A. Mechanisms of action on Escherichia coli of cecropin P1 and PR-39, two antibacterial peptides from pig intestine[J]. Infect. Immun., 1993, 61:2 978~2 984
9 Shi J, Ross C R, Leto T L, et al.PR-39, a proline-rich antibacterial peptide that inhibits phagocyte NADPH oxidase activity by binding to Src homology 3 domains of p47 phox[J]. Proc Natl Acad Sci USA., 1996, 93: 6 014~6 018
10 Andrea G, Oscar C, Francosco I, et al. Antimicrobial activity of polycationic peptides[J]. Peptides, 1999, 20: 1 263~1 273
11 Delfino D, Cusumano VV, Tomasello F, et al. Beneficial effects of antibacterial peptide PR-39 in a neonatal murine model of endotoxic shock[J]. New Microbiol, 2004, 27(4): 369~374
12 Linde CM, Hoffner SE, Refai E, et al. In vitro activity of PR-39, a praline - arginine -rich peptide, against susceptible and multi-drug-resistant Mycobacterium tuberculosis[J]. J. Antimicrob. Chemother, 2001,47:575~580
13 Phillip H. A. Lee, Takaaki Ohtake, Mohamed Zaiou, et al. Expression of an additional cathelicidin antimicrobial peptide protects against bacterial skin infection [J]. PNAS, 2005,102(10):3 750~3 755
14 Huang H., Ross C.R., Blecha F. Chemoattractant properties of PR-39, a neutrophil antibacterial peptide[J].J. Leukoc. Biol. 1997,61:624~629
15 Ramanathan B, Wu H, Ross CR, et al. PR-39, a porcine antimicrobial peptide, inhibits apoptosis: involvement of caspase-3[J]. Dev Comp Immunol, 2004,28(2):163~169
16 Gallo R.L., Ono M., Povsic T., et al. Syndecans, cell surface heparan sulfate proteoglycans, are induced by a proline-rich antimicrobial peptide from wounds[J]. Proc. Natl Acad. Sci. USA. 1994,91:11 035~11 039
17 Ohtake T., Fujimoto Y., Ikuta K., et al. Proline-rich antimicrobial peptide, PR-39 gene transduction altered invasive activity and actin structure in human hepatocellular carcinoma cells[J]. Br. J. Cancer, 1999,81:393~403
18 James PE, M Madhani, Ross C, et al. Tissue hypoxia during bacterial sepsis is attenuated by PR-39, an antibacterial peptide[J]. Adv Exp Med Biol, 2003, 530: 645~652
19 Al-Mehdi A.B., Zhao G., Dodia C., et al.Endothelial NADPH Oxidase as the source of oxidants in lungs exposed to ischemia or high K+[J]. Circ. Res. 1998,83:730~737
20 Robert EW,Hancock,Gil D.The role of cationic anirimicrobial peptides in innate host defences[J].Trends in Microbiology,2000,8:4 021
21 汪以真,韩新燕,许梓荣.哺乳动物抗菌肽及其在畜牧生产上应用前景[J].中国畜牧杂志,2002,38:52
(编辑:张学智,mengzai007@163.com)
王燕,浙江大学动物分子营养学教育部重点实验室,310029,浙江大学饲料科学研究所。
汪以真,单位及通讯地址同第一作者。
收稿日期:2006-03-27
★ 国家基金课题(NO.30571348)资助项目 健康





